当前位置:首页 > 锦秋A-Level频道 > A-level > 21年10月考试季考点解析 | A-Level化学U4考情回顾及备考指导
发布时间:2021-11-12 关键词:A-Level化学U4考情回顾及备考
摘要: A-Level化学属于科学类科目与A-Level物理、A-Level生物一样,一直被认为是最难的A-Level科目之一,其内容之复杂、知识量之庞大程度让很多同学“谈化色变”
A-Level化学属于科学类科目与A-Level物理、A-Level生物一样,一直被认为是最难的A-Level科目之一,其内容之复杂、知识量之庞大程度让很多同学“谈化色变”,但因其是核心科学之一在申请英国大学理工类专业时非常重要,所以还是受欢迎的A-Level科目之一下面我们一起跟着锦秋回顾下爱德思考试局2021年10月考试季A-Level化学U4考情解析!
A-Level化学U42021年10月考题分析
• 考试日期:2021年10月18日
• 考试时长:1小时45分
• 考试题目:共计20道
Q1、反应速率题。
(a) A 零级反应反应速率与反应物浓度无关,或者说速率方程中反应物浓度幂数为0。
(b) C 零级反应中由于速率方程没有浓度,速率常数k的单位等同速率。
(c) A 零级反应中速率不受浓度影像,速率--浓度图像为一条水平线;而浓度--时间图像是递减的一次函数。
Q2、D反应速率题。温度即分子动能的宏观体现,温度升高分子动能上升(玻尔兹曼分布中曲线右移);但活化能仅与反应路径或者说反应机理有关,不受温度影响。
Q3、D 热力学总熵题。为何硝酸铵溶于水是吸热反应但极易发生。反应可以进行说明ΔStotal>0,因为是吸热反应所以ΔSsurr=-ΔH/T<0,那么ΔSsys必然大于0(且大于ΔSsurr绝 对值)
Q4、B 热力学总熵题。判断碳酸钙分解反应(吸热)的系统熵ΔSsys和环境熵ΔSsurr符号。因为固体生成气体所以系统熵增,因为吸热所以环境熵减。
Q5、D 热力学系统熵题。物质的标准熵的起点是绝 对零度下(的完美晶体),温度和物质状态皆会影响,状态改变时物质的标准熵会发生剧烈改变。
Q6、平衡常数题。
(a) C 平衡常数中只会出现溶质的浓度和气体的分压或浓度,有固体参与的异相平衡(heterogeneous equilibrium)不会出现在平衡常数表达式当中。或也可以理解为固体物质没有浓度或分压。
(b) B 正相反应吸热所以温度升高K的分子变大分母变小。
Q7、晶格能题。
(a) B 电子亲和能是指气态原子(或阴离子)接受电子变为气态阴离子的过程,注意此处是两个氯原子变为两个氯离子。
(b) A 根据图中箭头方向判断即可,伯恩-哈珀循环是盖斯循环的具体体现,遵循盖斯循环中焓变叠加原则。
(c) C 在x所对应的过程中气态镁原子直接变成了气态+2离子。
Q8、C 酸碱理论题。在布朗斯特-劳里酸碱理论中,酸碱反应是酸和碱反应生成酸和碱。
Q9、C (强碱)pH计算题。溶液中氢氧根离子浓度为0.02mol dm-3。
Q10、B 同分异构题。香茅醇是一个老题了,分子中虽然有双键但不满足“two different parts bonded to two carbon”,只有3号位的手性碳使其有光学异构题。
Q11、D分子间作用力题/醛的物理性质题。乙醛本身并没有O-H结构,无法形成氢键,熔沸点高于丙烷是因其是一个极性分子,可产生取向力(permanent dipole force);而其氧原子上的孤对电子可与水分子的氢形成氢键。
Q12、A 有机鉴别题(醛酮)。
Q13、C 有机反应题(羧酸)。得到羧酸的方法主要有三种:醇或醛的氧化、酯的水解、腈的水解,此处需注意酯的命名方法,来自醇的部分将被视作取代基,来自羧酸的部分改为-oate皆为作主名。
Q14、A 缩聚题(聚酯)。注意数聚酯中来自醇的部分的碳链长度既可。
Q15、B 羧酸反应题(酯化反应)。酸可同时催化正逆两向反应,降低活化能对于正逆两向反应皆适用;另外碱可通过消耗水解产物羧酸的方式推动方应向水解侧移动。
Q16、(a) 经验式题。
(i) 为什么与X反应的氧气必须干燥?因为有谁会影响对产物中水的测定:water in product need to be measured。
(ii) 证明经验是C4H6O3。与所有经验式题目一样,以燃烧产物二氧化碳和水的质量推算碳与氢原子物质的量:nC = nCO2 = 4.31g÷44g mol-1 = 0.0975mol; nH = 2nH2O = 1.32g÷18g×2 mol-1=0.1467。氧的物质的量通过从总质量中扣除碳氢质量实现:mO=mtotal-mC-mH=2.5g-0.0975mol*12g mol-1-0.1467mol*1g mol-1=1.178g nO=m÷M=1.178g÷16g mol-1=0.07362mol。具体的经验式推断较依赖经验,具体来说将较多的与较少的物质的量相除可得:nH:nC=0.1467÷0.0975=1.5046:1≈1.5:1≈3:2;nH:nC=0.1467÷0.07362=1.992:1≈2:1;the simplest whole number ratio of C:H:O is 4:6:3。此题较为复杂,好在是个证明题,结果不对说明过程肯定有问题,在沉住气一点一点找就可以了。
(b)
(i) 有机综合推断题。根据信息推断X可能的两种结构。此类题目难度较高,既有化学分析也有仪器分析,做题时先要从题干信息进行推断。①与布兰迪试剂反应说明是醛或者酮react with Brady’s reagent indicate X has aldehyde or ketone group;②不与土伦试剂反应说明不是醛no reaction with Tollen’s reagent indicate there is no aldehyde group in X;③那就只能是酮了 which means it has ketone group;④与碳酸氢钠反应生成使石灰水浑浊的气体说明X中有羧基reaction with NaHCO3 indicate there’s carboxylic acid group in X;⑤结合(a)问中的分子式可推导出X有且仅有两种结构,即:

除此二者之外其他的推导皆有醛基,如羰基在4号位或主碳链长度为三(prop)时。
⑥最后C-13核磁共振中有四个峰说明有四种碳,符合前述推断four peaks in C-13 NMR indicate 4 different kinds of C in X, consist with the deduced structure.
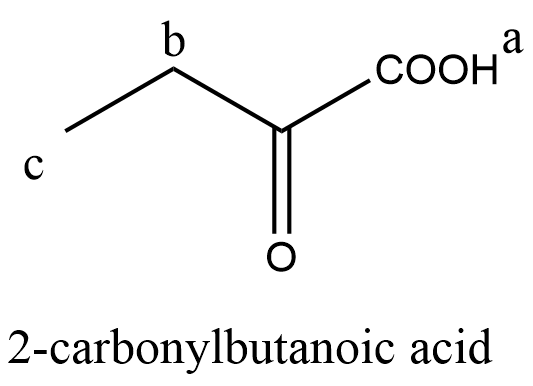
(ii) 写出能够区分此二种结构的有机试剂。化学手段只有碘仿反应能够区分二者:use iodine and (concentrated) sodium hydroxide solution; 3-carbonylbutanoic acid will give pale yellow precipitate with antiseptic smell, while 2-carbonylbutanoic acid has no change。不会命名可用结构式甚至编号代替。
(c)
根据核磁共振氢谱推断X的最终结构,其实峰高数据会比化学位移数据更有用。①peaks at about2.2 indicate H-C=O(1.8~2.8);② 1.9 indicate H-C-C(-0.9~1.9)(实际上1.9处两种氢的吸收会有重叠,难以分辨具体归属);③peak at about 11 indicate -COOH;④peak height ratio 1:2:3;⑤the information corresponding to hydrogen in position 4’, 3’ and COOH for 2-carbonylbutanoic acid。

Q17、(a) 浓度-时间图像题。
(i) 画图描点即可,注意标定坐标轴并写单位:横轴是time/s纵轴是[C6H5N2Cl]/mol dm-3。要保证数点在横纵两个维度都占到图的一半以上。
(ii) 从图中找浓度减半对应的时间,第 一个半衰期大概在125s(第二个在250s)。
(iii) 推知k=ln2÷125s=5.545×10-3s-1。
(c) 阿伦尼乌斯方程题。
(i) 依上一问的数据推导新数据点。简单进行计算即可:lnk=-5.195; 1/T=0.0030。
(ii) 将数据描在图中。作为数点即:(0.0030, -5.195)
(iii) 此类题目非常固定,任取两点计算斜率即可,不要忘记画线。以首末二点为例:由图可知(0.03078,-6.1), (0.03475,-11.8);求得斜率=-1435.77。注意lnk是没有单位的,做对数都会失去单位,所以此直线斜率单位应为K(开尔文),对应1/T单位K-1。
(iv) 由前问gradient=-Ea/R=-1435.77K;Ea=+11931J mol-1=+11.93kJ mol-1。不管是由计算还是由经验都可知Ea应为正值(吸热)。
Q18、论述类六分大题。论述伯(primary)和仲(tertiary)卤代烃水解反应机理的不同,此题得分点不好找,只能分别相信论述两种机理。①primary halogenoalkane undergoes SN2 while tertiary halogenoalkane undergoes SN1;②because primary halogenoalkane has relative small parts around the carbon bonded to halogen, while tertiary carboncation is relatively stable;③in SN2, concentration of both halogenoalkane and hydroxide ion are direct proportional to the rate/both concentration has a power of 1;④mechanism involves a transition state with two partial bonds;⑤in SN1, only concentration of halogenoalkane is directly proportional to rate (while hydroxide ion concentration has a power of 0);⑥the mechanism involves a carboncation intermedia。此题只说不需要箭头机理,以文字或图像描述过渡态/中间产物应该是有分的,但是叙述产物的光学活性应该没分。
Q19、1. (a)平衡常数题
(i) 写出Kp表达式,这个比较传统,注意是分压的形式。
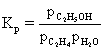
计算Kp。需先算出到达平衡时三种物质的量:
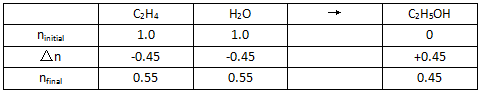
进而算出三种物质的分压:
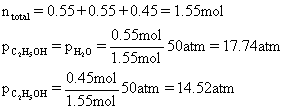
最后代入Kp表达式得到结果:
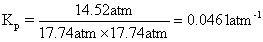
(b) 工业反应条件题。此题中阐述了温度压力两方面,且需分别考虑更高和更低的影响。①higher temperature will lead to lower yield, due to the exothermic forward reaction;②lower temperature and pressure will lead to lower reaction rate;③higher pressure will lead to higher cost/safety problem (although has higher rate and yield);④compromise had to be made when selecting temperature and pressure.
Q20、(a) (弱酸)pH计算题。
(i) 硫酸氢根离子解离的方程式。HSO4- → H+ + SO42-
(ii) 以pH值和pKa计算此弱酸(根)离子浓度,此处需要将pKa转化为Ka = 10-1.92 = 0.01202 mol dm-3
将pH转化为氢离子浓度[H+] = 10-1.13 = 0.7413 mol dm-3
然后带入弱酸情况下的酸解离常数表达式:
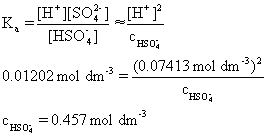
(iii) 在弱酸pH计算中用到的假设。固定答案:忽略水的电离ignore dissociation of water/H+ from
water;忽略弱酸的电离ignore dissociation of weak
acid。两部假设都是基于加减运算中的“20倍原则”,即加减小于数值本身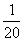
的数时,加减即可忽略。
(b) 缓冲溶液题。
(i) 缓冲溶液的定义:when extra small amount of acid or base added, pH barely change
(ii) 计算缓冲溶液pH值。先计算混合后两溶质浓度,此处题目设置较为简单,而这直接就是0.5 mol dm-3和0.75 mol dm-3;然后将两个浓度代入缓冲溶液情况下的解离常数表达式:
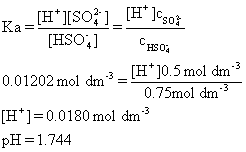
(iii) 计算盐酸加入水中和缓冲溶液中引起的pH变化。

(c) 滴定曲线题。这个题出得比较有新意,不仅仅考察了传统的滴定指示剂选择,还详细的问了选择甲基橙做指示剂是能详细观察到的现象。答案必包含以下三点:①溶液在到达等价点前就会变色solution will change colour before equivalence point reached/等价点无法通过指示剂颜色变化观测equivalence can not be observed by colour change of indicator;②溶液颜色将逐渐由红色变为黄色solution will turn from red to yellow gradually;③因为变色范围落在缓冲区due to the range of indicator lies in buffer region/在指示剂变色范围内pH将缓慢变化pH will change slowly/gradually in range of indicator。

